Bilangan Kuantum
Bilangan kuantum adalah bilangan yang menyatakan kedudukan atau posisi elektron dalam atom yang diwakili oleh suatu nilai yang menjelaskan kuantitas kekal dalam sistem dinamis(wikipedia). Kalau kita lihat pengertian dari wikipedia, memang agak rumit maka dari itu kita simpulkan aja nih apa sih bilangan kuantum itu, bilangan kuantum adalah bilangan yang nunjukin bahwa si elektron tuh aktivitas di dalam kamar(orbital)nya itu gimana, dengan jenis jenisnya lagi yang berbeda. Maka dari itu yok kita caw langsung dah ke jenis-jenis si Bilangan kuantum itu gimana sih..
Untuk
Memahami penjelasan selanjutnya, coba kita andaikan dulu deh elektron itu atom
itu sebagai hotel dan elektron itu sebagai pengunjungnya.. Oke paham nih
paham??
Jenis
Jenis bilangan kuantum adalah:
- Bilangan kuantum utama (n) yang menyatakan tingkat energi.
- Bilangan kuantum azimut/momentum sudut (l) yang menyatakan bentuk orbital, kalau singkatnya mah orbitalnya ini tuh punya berapa kamar.
- Bilangan kuantum magnetik (m) yang menyatakan orientasi orbital dalam ruang tiga dimensi, jadi si elektron itu ada di kamar berapa.
- Bilangan kuantum spin (s) yang menyatakan arah elektron pada sebuah atom, jadi arah si elektron dalam kamar(orbital)nya itu gimana sih.
Bilangan
kuantum utama (n)
Bilangan
kuantum utama (primer) digunakan untuk menyatakan tingkat energi
utama yang dimiliki oleh elektron dalam sebuah atom. Bilangan kuantum utama
tidak pernah bernilai nol. Bilangan kuantum utama dapat mempunyai nilai semua
bilangan positif, yaitu 1,2,3,4 dan seterusnya. Sedangkan kulit atom dinyatakan
dengan huruf K,L,M,N dan seterusnya. Jadi kalau buat memahaminya sih kita gk
perlu ribet, bayangin aja ini sebagai lantai dari sebuah hotel yang dinyatakan
dengan simbol huruf dari K sampai seterusnya.
Kulit
|
K
|
L
|
M
|
N
|
Nilai n
|
1
|
2
|
3
|
4
|
contoh:
n=1
elektron berada pada kulit K;
n=2
elektron berada pada kulit L;
n=3
elektron berada pada kulit M;
n=4
elektron berada pada kulit N; dan seterusnya
Bilangan kuantum utama juga berhubungan dengan jarak rata-rata elektron dari inti dalam orbital tertentu. Semakin besar n, semakin besar jarak rata-rata elektron dalam orbital tersebut dari inti dan oleh karena itu semakin besar orbitalnya.
Bilangan
kuantum azimut / momentum sudut (l)
Bilangan kuantum azimut
sering disebut bilangan kuantum anguler (sudut). Energi sebuah elektron
berhubungan dengan gerakan orbital yang digambarkan dengan momentum sudut.
Momentum sudut tersebut dikarakterisasi menggunakan bilangan kuantum azimut.
Bilangan azimut menyatakan bentuk suatu orbital dengan simbol (l)
"huruf L kecil". Bilangan kuantum azimut juga berhubungan dengan
jumlah subkulit. Nilai ini menggambarkan subkulit yang dimana elektron berbeda.
Untuk subkulit s,p,d,f bilangan kuantum azimut berturut-turut adalah
0,1,2,3.
Nilai
bilangan kuantum azimut atau "l" ini bergantung pada nilai
bilangan kuantum utama atau "n" . Untuk nilai n
tertentu, l mempunyai nilai bilangan bulat yang mungkin dari 0 sampai (n-1).
Bila n-1, hanya ada satu nilai l yakni l =n-1=1-1=0. Bila n=2,
ada dua nilai l, yakni 0 dan 1. Bila n=3, ada tiga nilai l,
yakni 0,1, dan 2. Nilai-nilai l biasanya ditandai dengan huruf s,p,d,f...
sebagai berikut:
l
|
0
|
1
|
2
|
3
|
Nama orbital
|
s
|
p
|
d
|
f
|
Jadi
bila l =0, kita mempunyai sebuah orbital s; bila l =1,
kita mempunyai orbilat f; dan seterusnya.
Sekumpulan
orbital-orbital dengan nilai n yang sama seringkali disebut kulit. Satu
atau lebih orbital dengan nilai n dan l yang sama dirujuk selalu
subkulit. Misalnya kulit dengan n=2 terdiri atas 2 subkulit, l=0 dan
1 (nilai-nilai l yang diizinkan untuk n=2). Subkulit-subkulit
ini disebut subkulit 2s dan subkulit 2p di mana 2 melambangkan
nilai n, sedangan s dan p melambangkan nilai l.
Tabel
dibawah ini menunjukkan keterkaitan jumlah kulit dengan banyaknya subkulit
serta jenis subkulit dalam suatu atom.
Jenis subkulit
|
Jumlah orbital
|
Elektron maksimum
|
Subkulit s
|
1 orbital
|
2 elektron
|
Subkulit p
|
3 orbital
|
6 elektron
|
Subkulit d
|
5 orbital
|
10 elektron
|
Subkulit f
|
7 orbital
|
14 elektron
|
Udah cukup paham atau udah cukup bingung sama penjelasan yang ada diatas tadi?? Kalau bingung, yuk mending ambil simpulnya aja nih, Kan tadi dikatakan bahwa atom itu diibaratkan dengan hotel, elektron diibaratkan pengunjung dan kulit atom(kuantum primer) diibaratkan dengan lantai hotel, maka sekarang ibaratkan saja sub kulit(kuantum azimuth) sebagai kamar dari setiap hotel itu sendiri.
Dan untuk setiap kamar itu
ada kelas kelasnya, untuk kamar s memiliki
1 toilet, kamar p memiliki toilet 3,
kamar d memiliki toilet 5, dan kamar f memiliki toilet 7. Dan untuk 1 toilet
hanya bisa masuk 2 orang(elektron) saja. Paham belum nih?? Kalau belum paham
silahkan dibaca lagi..
Bilangan kuantum magnetik (m)
Bilangan kuantum magnetik menyatakan tingkah laku elektron dalam medan magnet. Tidak adanya medan magnet luar membuat elektron atau orbital mempunyai nilai n dan l yang sama tetapi berbeda m. Namun dengan adanya medan magnet, nilai tersebut sedikit berubah. Hal ini dikarenakan timbulnya interaksi antara medan magnet sendiri dengan medan magnet luar.
Bilangan
kuantum magnetik ada karena momentum sudut elektron, gerakannya berhubungan
aliran arus listrik. Karena interaksi ini, elektron menyesuaikan diri di
wilayah tertentu sekitar inti. Daerah khusus ini dikenal sebagai orbital. Orientasi
elektron di sekitar inti dapat ditentukan dengan menggunakan bilangan kuantum
magnetik m .
Di
dalam satu subkulit, nilai m bergantung pada nilai bilangan kuantum
azimut/momentum sudut l. Untuk nilai l tertentu, ada (2l + 1)
nilai bulat m sebagai berikut: -l, (-l + 1), ..., 0 , ... , (+l - 1),
+l
Bila
l =0, maka m=0. Bila l =1, maka terdapat tiga nilai m yaitu -1,0,dan
-1. Bila l =2, maka terdapat lima nilai m yaitu -2,-1,0,+1, dan +2. Jumlah m
menunjukkan jumlah orbital dalam subkulit dengan nilai l tertentu.
Nah jika masih pusing, gini nih intinya.. Untuk
bilangan kuantum magnetik berfungsi menyatakan berada di toilet mana nih si
pengunjung(elektron) terakhir tersebut, misalnya kita ambil contoh untuk kamar p
yang memiliki 3 toilet, dan ketiga toilet itu diberi label -1 0 dan +1, karena
aturan mengatakan bahwa pelabelan dimulai dari –l sampai dengan +l, maka ketika
si pengunjung(elektron) itu berada di toilet berlabel 0 berarti nilai bilangan
kuantumnya itu 0.. Paham gk paham harus ngerti yaa..
Bilangan kuantum spin (s)
Bilangan kuantum spin menyatakan momentum sudut suatu partikel. Spin mempunyai simbol "s" atau sering ditulis dengan ms (bilangan kuantum spin magnetik). Suatu elektron dapat mempunyai bilangan kuantum spin s = +1/2 atau -1/2.
Nilai
positif atau negatif dari spin menyatakan spin atau rotasi partikel pada sumbu.
Sebagai contoh, untuk nilai s=+1/2 berarti berlawanan arah jarum jam (ke
atas), sedangkan s=-1/2 berarti searah jarum jam (ke bawah). Diambil
nilai setengah karena hanya ada dua peluang orientasi, yaitu atas dan bawah.
Dengan demikian, peluang untuk mengarah ke atas adalah 50% dan peluang untuk ke
bawah adalah 50%.
Kalau
yang ini kita ibaratkan dengan arah jarum jam, yang artinya hanya ada 2 arah.
Ini juga sama berlaku pada kuantum spin yang hanya memiliki 2 arah. Arah atas
yang dinyatakan dengan + dan arah bawah yang dinyatakan dengan –
Dan
ingat arah atom itu mengisi kamar kamar yang ada di awali dengan arah atas yang
berarti positif hingga ketika kamarnya udah penuh dengan arah atas maka diisi
dengan arah bawah. Berarti jika si elektron itu berakhir di arah atas maka
nilainya +½ dan jika di arah bawah maka nilainya –½.. Semoga kalian paham, dan
jika masih belum paham nanti akan saya beri contoh di akhir sesi, oke oke?? Lanjut
dah ke Konfigurasi elektron..
Konfigurasi Elektron dan Diagram Orbital
Dalam penulisan konfigurasi elektron dan diagram orbital perlu
berlandaskan pada tiga prinsip utama yaitu prinsip aufbau, aturan Hund
dan aturan penuh setengah penuh.
Azas Aufbau
Azas Aufbau menyatakan bahwa :“Pengisian elektron dimulai dari subkulit
yang berenergi paling rendah dilanjutkan pada subkulit yang lebih tinggi
energinya”. Dalam setiap sub kulit mempunyai batasan elektron yang
dapat diisikan yakni :
Subkulit s maksimal berisi 2 elektron
Subkulit p maksimal berisi 6 elektron
Subkulit d maksimal berisi 10 elektron
Subkulit f maksimal berisi 14 elektron
Berdasarkan ketentuan tersebut maka urutan pengisian (kofigurasi) elektron mengikuti tanda panah pada gambar berikut!
Berdasarkan diagram di atas dapat disusun urutan konfigurasi elektron sebagai berikut :
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 …. dan seterusnya
Keterangan :
Jumlah elektron yang ditulis dalam konfigurasi elektron merupakan jumlah
elektron maksimal dari subkulit tersebut kecuali pada bagian
terakhirnya yang ditulis adalah elektron sisanya. Perhatikan contoh di
bawah ini :
Jumlah elektron Sc adalah 21 elekron kemudian elektron-elektron tersebut
kita isikan dalam konfigurasi elektron berdasarkan prinsip aufbau di
atas. Coba kalian perhatikan, ternyata tidak selalu kulit yang lebih
rendah ditulis terlebih dahulu (4s ditulis dahulu dari 3d). Hal ini
karena semakin besar nomor kulitnya maka selisih energi dengan kulit di
atasnya semakin kecil sementara jumlah sub kulitnya semakin banyak
sehingga terjadi tumpang tindih urutan energi sub kulitnya. Untuk
mempermudah penilisan tingkatenerginya digunakan prinsip aufbau di atas.
Untuk keteraturan penulisan, 3d boleh ditulis terlebih dahulu
dari 4s namun pengisian elektronnya tetap mengacu pada prinsip aufbau.
hal ini terkesan remeh tapi penting..... jadi bila kalian disuruh
menuliskan bilangan kuantum dari elektron terakhir dari Sc maka elektron
tersebut terletak pada sub kulit 3d bukan 4s, walau dalam penulisan
terakhir sendiri adalah sub kulit 4s.....cirinya pada sub kulit 3d tidak
terisi penuh elektron sedangkan sub kulit 4s nya terisi penuh.
Penulisan konfigurasi elektron dapat disingkat dengan penulisan atom
dari golongan gas mulia yaitu : He (2 elektron), Ne (10 elektron), Ar
(18 elektron), Kr (36 elektron), Xe (54 elektron) dan Rn ( 86 elektron).
Hal ini karena pada konfigurasi elektron gas mulia setiap sub kulitnya
terisi elektron secara penuh.
Konfigurasi elektron dalam atom selain diungkapkan dengan diagram curah
hujan, seringkali diungkapkan dalam diagram orbital. Ungkapan yang kedua
akan bermanfaat dalam menentukan bentuk molekul dan teori hibridisasi.
Yang harus diperhatikan dalam pembuatan diagram orbital :
1. Orbital-orbital dilambangkan dengan kotak
2. Elektron dilambangkan sebagai tanda panah dalam kotak
3. Banyaknya kotak ditentukan berdasarkan bilangan kuantum magnetik, yaitu:
4. Untuk orbital-orbital yang berenergi sama dilambangkan dengan
sekelompok kotak yang bersisian, sedangkan orbital dengan tingkat energi
berbeda digambarkan dengan kotak yang terpisah.
5. Satu kotak orbital berisi 2 elektron, satu tanda panah mengarah ke
atas dan satu lagi mengarah ke bawah. Pengisan elektron dalam
kotak-kotak orbital menggunakan aturan Hund.
Aturan Hund
Friedrich Hund (1927), seorang ahli fisika dari Jerman mengemukakan aturan pengisian elektron pada orbital yaitu :
“orbital-orbital dengan energi yang sama, masing-masing diisi lebih dulu
oleh satu elektron arah (spin) yang sama dahulu kemudian elektron akan
memasuki orbital-orbital secara urut dengan arah (spin) berlawanan atau
dengan kata lain dalam subkulit yang sama semua orbital masing-masing
terisi satu elektron terlebih dengan arah panah yang sama kemudian sisa
elektronnya baru diisikan sebagai elektron pasangannya dengan arah panah
sebaliknya”.
Coba perhatikan contoh diagram elektron di bawah ini, khususnya pada bagian akhirnya :
Pada pengisian diagram orbital unsur S pada konfigurasi 3p4, 3 elektron
diisikan terlebih dahulu dengan gambar tanda panah ke atas baru sisanya 1
elektron digambar dengan tanda panah ke bawah.
Larangan Pauli
Pada tahun 1928, Wolfgang Pauli
(1900-1958) mengemukakan bahwa tidak ada dua elektron dalam satu atom
yang boleh mempunyai keempat bilangan kuantum yang sama. Orbital yang
sama akan mempunyai bilangan kuantum n, l, m yang sama. Dengan demikian,
yang dapat membedakan hanya bilangan kuantum spin (s). Setiap orbital
hanya dapat berisi 2 elektron dengan spin (arah putar) yang berlawanan.
Dengan adanya larangan Pauli ini, maka
elektron yang dapat menempati suatu subkulit terbatas hanya dua kali
dari jumlah orbitalnya. Jumlah maksimum elektron adalah sebagai berikut :

Silahkan perhatikan beberapa contoh dibawah ini :
Suatu atom unsur memiliki nomor atom 15. Tentukan :
- Konfigurasi elektron berdasarkan uraian kelas 1
- Gambaran orbital dari konfigurasi elektron yang telah anda buat
- Ke empat bilangan kuantum dari elektron terakhir pada konfigurasi elektron
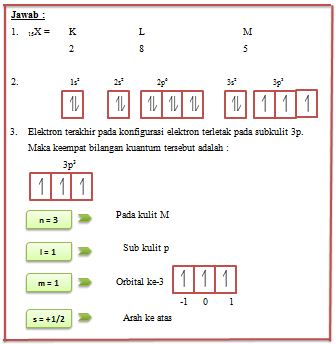
Aturan Penuh Setengah Penuh
Sifat ini berhubungan erat dengan hibridisasi elektron. Aturan ini
menyatakan bahwa : “suatu elektron mempunyai kecenderungan untuk
berpindah orbital apabila dapat membentuk susunan elektron yang lebih
stabil.....untuk konfigurasi elektron yang berakhiran pada sub kulit d
berlaku aturan penuh setengah penuh. Untuk lebih memahamkan teori ini
perhatikan juga contoh di bawah ini :
24Cr = 1s2 2s2 2p6 3s2 3p6 4s2 3d4 menjadi 24Cr = 1s2 2s2 2p6 3s2 3p6 4s1 3d5
dari contoh terlihat apabila 4s diisi 2 elektron maka 3d kurang satu elektron untuk menjadi setengah penuh....maka elektron dari 4s akan berpindah ke 3d. hal ini juga berlaku untuk kasus :
29Cu = 1s2 2s2 2p6 3s2 3p6 4s2 3d9 menjadi 29Cu = 1s2 2s2 2p6 3s2 3p6 4s1 3d10
Penentuan Periode dan Golongan Suatu Unsur
Untuk menentukan letak periode suatu unsur relatif mudah. Periode suatu
unsur sama dengan nomor kulit terbesarnya dalam konfigurasi elektron.
musalnya :
24Cr = 1s2 2s2 2p6 3s2 3p6 4s1 3d5
Nomor kulit terbesarnya adalah 4 (dalam 4s1) maka Cr terletak dalam periode 4
Sedangkan untuk menentukan golongan menggunakan tabel. Bila subkulit
terakhirnya pada s atau p maka digolongkan dalam golongan A (utama)
sedangkan bila subkulit terakhirnya pada d maka digolongkan dalam
golongan B (transisi). Lebih lengkapnya coba perhatikan tabel di bawah
ini :
Coba kalian perhatikan tabel di atas. Untuk memudahkan pengingatan
golongan A dimulai dari golongan I A sedangkan golongan B dimulai dari
III B. selain itu jika subkulit terakhirnya p atau d maka sub kulit s
sebelumnya diikutkan. Pada golongan VI B dan I B berlaku aturan penuh
setengah penuh.
Sebagai contoh :
24Cr = 1s2 2s2 2p6 3s2 3p6 4s1 3d5
Periode = 4
Golongan = VI B
Ending Pembelajaran
Nah setelah kita tahu mulai dari teori-teori
mengenai bilangan kuantum sampai dengan penerapannya pada konfigurasi elektron
yang di ikat oleh aturan aufbau, hund, pauli, dan aturan penuh setengah penuh,
maka finalnya itu tidak lain tidak bukan adalah kesimpulan dan contoh
keseluruhan.. Tapi untuk kesimpulan kayaknya kalian udah bisa deh menyimpulkan,
berarti saya hanya akan memberi sebuah soal dengan cara atau kunci jawabannya
untuk semua materi ini.. Sebelumnya saya mohon maaf atas segala kekurangan saya
dalam menjelaskan dan membuat artikel ini secara keseluruhan, Terima kasih atas
kunjungannya di blog Mighrofah Coorporation ini, See you..
Contoh Soal























https://belajarkimiaonlineyuk.wordpress.com
BalasHapushttps://mediabelajaronline.blogspot.co.id/2010/09/konfigurasi-elektron-dan-diagram.html
BalasHapus